Um novo estudo descobriu um mecanismo que permitiria que comunidades bacterianas se organizassem em padrões sofisticados
Ele está prestes a acabar atropelado, sua mãe o salvaUm novo estudo americano descobriu a existência de um mecanismo genético que permitiria que as comunidades bacterianas se organizassem em padrões surpreendentemente sofisticados.
As células bacterianas também se organizam em comunidades complexas, muito parecidas com as de plantas ou animais. Isso é o que emergiu de um novo estudo surpreendente conduzido por biólogos da Universidade da Califórnia em San Diego, que descobriram características particulares possuídas por bactérias que vivem em comunidades conhecidas como biofilme. Os biofilmes também são muito comuns no nosso dia-a-dia: nós os encontramos em canos de esgoto, em bancadas de cozinha, até mesmo na superfície de nossos dentes. As bactérias que vivem nessas comunidades usam sistemas sofisticados para se comunicarem, como também demonstrado por este estudo.
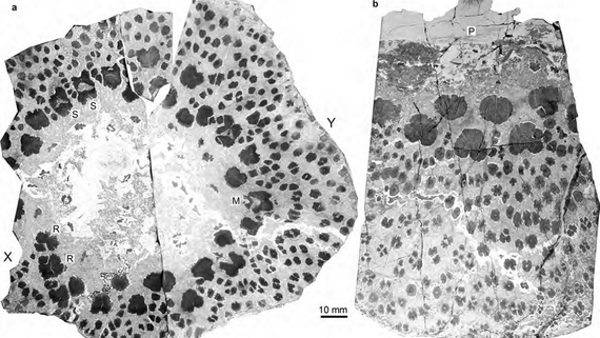
Agora, novas observações trouxeram ao conhecimento da literatura científica outra característica peculiar dessas comunidades bacterianas, demonstrando que sua estrutura é muito mais complexa do que se pensava anteriormente: as células do biofilme, de fato, são organizadas de acordo com padrões elaborados. característica, esta, até agora atribuída apenas a organismos mais desenvolvidos, como animais ou plantas.
Estamos percebendo que os biofilmes são muito mais sofisticados do que pensávamos - disse Gurol M. Suel, um professor da UC San Diego entre os autores do estudo. - De uma perspectiva biológica, nossos resultados sugerem que o conceito de padronização celular durante o desenvolvimento é muito mais antigo do que se pensava anteriormente. Aparentemente, a capacidade das células de se segmentar no espaço e no tempo não surgiu apenas com plantas e vertebrados, mas pode remontar a mais de um bilhão de anos.
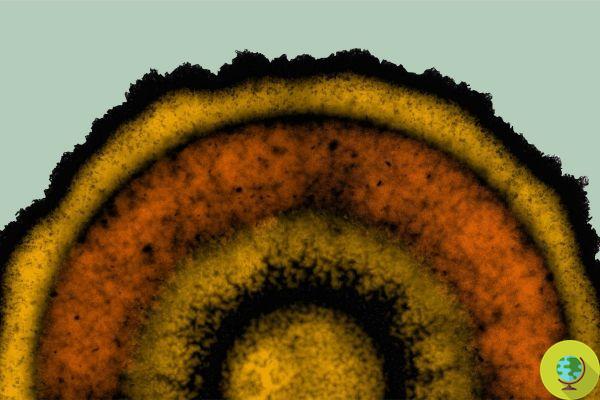
Por meio desse estudo, os cientistas tentaram explicar como as várias células que compõem o biofilme, apesar de serem tão diferentes umas das outras, conseguiam se comunicar e se organizar em padrões complexos. Para isso, foi desenvolvido um modelo matemático que revelou a existência de um mecanismo antes observado apenas em organismos altamente evoluídos (plantas, animais e humanos): à medida que o biofilme se expande, criam-se anéis concêntricos que expressam os diferentes níveis da comunidade bacteriana .
Nossa descoberta demonstra que os biofilmes bacterianos empregam um mecanismo de modelagem de desenvolvimento até então considerado exclusivo de vertebrados e sistemas vegetais. Agora entendemos que as comunidades bacterianas não são apenas células sanguíneas - explica o professor Suel. - Conhecer o complexo sistema bacteriano permite-nos dar algumas respostas às questões relativas aos sistemas vertebrados e vegetais, pois as bactérias oferecem sistemas mais acessíveis experimentalmente que podem fornecer novos insights para o campo do desenvolvimento.
Os biofilmes, como dissemos, são encontrados em todos os lugares e fazem parte do nosso dia a dia, por isso os resultados do estudo oferecem implicações interessantes para uma infinidade de áreas de pesquisa - da medicina à indústria alimentícia e até militar.
Siga seu Telegram | Instagram | Facebook | TikTok | Youtube
Fontes: University California San Diego / Cell
Também recomendamos:
- Estas bactérias recriaram acidentalmente a "Noite Estrelada" de Van Gogh
- Infelizmente, as ostras estão se tornando gananciosas por microplásticos devido às bactérias que se instalam nelas
- Leite materno rosa? Pode ser culpa de uma bactéria